IBSとSIBO:過敏性腸症候群と小腸内細菌増殖症(95の論文分析)
IBSとSIBO:過敏性腸症候群と小腸内細菌増殖症(95の論文分析)
・・・・・・・・・・・・・・・・
IBSとSIBOの関係について、95編の文献をもとに記載されたレビュー論文を元に解説する。このレビュー論文では、IBSにSIBOが存在することを認めたうえで、どれくらい存在するのかは、正確で簡易な検査の開発が望まれると結語している。
過敏性腸症候群と小腸内細菌増殖症
意味のある関連性と不要な誇大解釈
Irritable
bowel syndrome and small intestinal bacterial overgrowth: Meaningful
association or unnecessary hype
Uday C
Ghoshal and Deepakshi Srivastava
W J Gastroenterol. 2014(3月14日)29:2484-2491.
<アブストラクト>
過敏性腸症候群(IBS)は、腹痛や不快感、膨満感、および便の形や便通の変化という一般的な症状特徴としている。小腸細菌異常増殖(SIBO)は、上部消化管の吸引液の培養で1ml中、細菌の異常増殖が10万を超えて小腸に存在している状態である。IBSの患者の間でのSIBOの頻度は4~78%、IBSのないコントロールでは1〜40%とさまざまな報告がある。IBSとSIBOに高い関連性があると結論したいくつかの研究では、ラクツロース-水素呼気の上昇は90分以内基本的には20ppm(初期ピーク)であるにもかかわらず、誤った判断基準によるものである可能性がある。また、グルコース水素呼気試験(GHBT)はSIBOを診断するための感度が低いため、GHBTに基づく研究はIBSとSIBOの関係を過小評価する可能性がある。したがって、IBSとSIBOの関係の報告については、慎重に研究結果を分析する必要がある。このレビューはSIBOとIBSの関係について、方法論的な問題とIBSの症状に対する腸内細菌叢の治療方法に関する証拠を含む様々な研究で、それらの研究自体の強さと弱さの間で不一致との間の関連についての研究を評価するものである。
論点の中核:過敏性腸症候群(IBS)は、従来、感染の影響などのない(有機的でない)胃腸障害であると考えられてきた。しかし、最近のデータは、少なくとも患者に有機的であってもよいことを示すことが浮上している。いくつかの研究は、小腸細菌異常増殖(SIBO)とIBSの関連性を報告したものの、SIBOの頻度は4%及び78%の間で変化することが報告された。最近のレビューではSIBOとIBSとの間の密接な関係を示唆しているが、IBSにSIBOの高い有病率を報告した研究は、誤った診断方法によって過大評価している可能性がある。IBSの患者にSIBOを診断するためのより良いテストが非常に必要とされている。
・・・・・・・・・・・・・
<論文の本文>
はじめに
過敏性腸症候群(IBS)は、便通の変化(下痢、便秘などの)と便の形状に関連付けられた腹部の痛みや不快感、膨満感、を特徴とする一般的な症状である。(補足:2016年のRome Ⅳで改訂された基準には不快感や膨満感を含まない)IBSの世界的な有病率は4~30%である(文献1-7)。小腸内細菌異常増殖(SIBO)は、従来、回腸の吻合術後に狭窄、瘻孔、消化管運動の減少、腸内の解剖学的異常などを有する場合に、腸の細菌感染によって腹部の痛みや不快感、膨満感、鼓腸を生じる疾患という概念であった(文献8-10)。(補足:この疾患概念は、胃切除の手術で、胃が無くなった人で、食べた物がすぐに小腸へ移動した場合に、急激な血糖上昇に伴う反射性の高インスリン血症によって低血糖反射を来すダンピング症候群を予防するために、小腸を利用して一旦小腸に食べ物を蓄積させる袋(盲管:ブラインドループ)という手術をした場合に、そのブラインドループ内に菌が増殖して、下痢、腹痛、ビタミンB12欠乏などを来すブラインドループ症候群から始まった)しかし、最近では、手術後の患者や解剖学的な異常がない場合でもSIBOが起こり得ることが分っている(文献11)。そして、多くのSIBOの患者はIBSと誤診されている可能性がある。
SIBOの診断は、空腸の吸引液の培養で、10万を超える細菌(空腸の吸引液1ミリリットル当たりのコロニー形成単位)が存在することと定義される(文献12,13)。(補足:通常、小腸の細菌数は1mlあたり1万以下であり、それらの菌は胆汁酸代謝などの有益な作用を有している。胃を越えて十二指腸からの液吸引では、細菌数が少ないため、空腸での吸引が行われている。しかし、空腸のどの場所から採取するかは規定されていないという問題がある。通常の胃十二指腸の内視鏡検査では、空腸まで内視鏡を挿入しようとすると、患者は苦痛を生じる。また、一番問題なのは、空腸に吸引できるだけの空腸液が存在しないことが多いということである。空腸の液は多くは気泡となっていて、吸引しても、内視鏡の中の吸引管を満たす程度で、純粋に空腸液を1ml採取することは困難である。そのため、空腸内に水を送水して、回収するしかないが、その場合には細菌濃度が薄まってしまう)しかし、この方法は、空腸まで内視鏡を行う必要があり、侵襲的なテストであるので、ラクツロース及びグルコース水素呼気検査(LHBTとGHBT)を含むいくつかの非侵襲的方法が一般にSIBOを診断するために使用されている(文献14-18)。SIBOへの関心は、IBSの患者の間で高まってきている。(補充:ラクツロースやグルコースが空腸の細菌によって発酵して水素を産生し、その水素を測定することによって細菌の増加を推察するという理論である。しかし、最近では胃の中にもピロリ菌以外の多数の細菌が存在していることがわかっており、私の実験でも、ラクツロースによって胃内でガスが発生する症例が少なくないことを確認している)
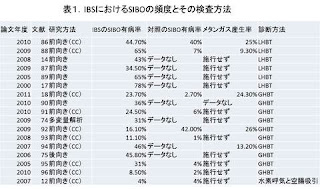
これまでの研究では、IBSを呈する患者の間でSIBOの頻度は4~78%と広い幅がり、さらに下痢型IBSの患者の間でより多く(文献12、14、18、19)のデータが散見される(表1)。
(表1)
SIBOの誇大解釈が、腸内細菌(腸内毒素症)における質的な変化のみならず、IBS の患者間で報告されている(文献20)。
そして、これらの研究は、IBSの病因の理解のパラダイムシフト(科学的革命)につながったとして抗生物質、プロバイオティクスと、最近では糞便移植使用して、この謎の慢性疾患を治療するための腸内細菌叢の治療操作に関する議論の増加につながっている(文献21-23)。しかしながら、IBSとSIBO患者間の関連性が低いとする報告や高いとする報告の広い範囲があることを認識することが重要である。なぜ、このように、IBSとSIBOの関係に幅があるのか?を重点において検証する。
IBSにおけるSIBOに関する研究のレビューの核心
IBS患者におけるSIBOの頻度は1〜40%のコントロールに比して、4~78%であった。ほとんどの研究では、IBSの患者のうち、SIBOの頻度は、対照の間でより高かった。従って、SIBOがIBSと関連していると結論することができる。しかし、それは決定的に異なる研究におけるSIBOの頻度のような広い変動の理由を評価することが重要である。
不一致の理由:IBSにおけるSIBOに関する研究の批判的評価
IBSの表現型は、SIBOの頻度を決定することができるのか?
IBSは複数の症状が複合した病像を呈すためにグループ(サブタイプ)に分けられる。たとえば、下痢型、便秘型、あるいは交替型などである。下痢優勢なIBSを持った患者は、他のサブタイプのIBSよりSIBOを含む器質的原因をよりしばしば持っている。下痢のないIBS73人、下痢優勢なIBSを含む慢性の非特異性の下痢のある51人、および健常対照群129人に関する研究では、GHBTを使用したSIBOの頻度は、それぞれ11(8.5%)、16(22%)および1(2%)であった(文献16)。このような結果は他の報告でもみられ(文献18、24)、調査対象に下痢型IBSの患者が大きな割合を含めた研究は、結果的にIBSとSIBOの高い関連示す可能性が高いと言える。(補足:先に述べたように、小腸内の細菌増加による下痢はブランドループ症候群の症状である)
腹部膨満感は、IBSの患者で頻度の高い症状である。IBSにおける膨満感の頻度はアジアの研究で26~83パーセントと、その頻度の幅が広いことが報告されている(文献3,25)。膨満感の病因は、腸内のガス量の増加、その異常分布と腸の膨満に応答した内臓知覚に関連している可能性がある(文献26、27)。SIBO患者は、腸の内部のガスが増加しているため、IBS患者がSIBOによって腹満感を持つことは論理に合致している(文献16)。しかし、この問題に関するデータは限られている。いくつかの研究では、絶食下でも呼気テスト(グルコース、ラクツロース)の水素はコントロールよりも、IBSの患者の間で高くなっていた(文献16,28)。腸内のガスを低減することが知られているプロバイオティクスおよび抗生物質は、IBSを有する患者で腹部膨満感を軽減することが知られている(文献17、29、30)。抗生物質による治療を行った場合、症状の改善とともに、水素呼気検査結果を正常にすることが報告されている(文献17)。したがって、著しい膨満感や鼓腸とIBSの患者は、特にSIBOのために評価されるべきである。しかし、さらなる研究を、この問題について必要とされる。
診断方法はIBSにおけるSIBOの関係率を決定するか?
SIBOを診断するためにいくつかの技術が使用されている。LHBT、GHBT、14Cキシロース呼気試験(補足:放射線同位元素を用いた研究)、および空腸吸引液の培養である(文献12、15、31、32)。水素呼気検査の原理は、小腸で吸収されない食物中の炭水化物は大腸で細菌発酵により水素を生成するが、SIBO患者で小腸に細菌があると小腸で炭水化物が発酵し、呼気中に小腸内発酵による水素を検出するというものである(文献33)。
水素呼気テストは、患者に(通常、グルコースおよびラクツロースの形態で)炭水化物の負荷を与え、ある時間にわたって水素濃度を測定するものである。水素呼気試験を用いたSIBOの診断は、SIBOを有する患者において、グルコースと小腸内細菌によって発酵される水素ガスが産生され、その水素ガスが吸収されて、呼気中に吐き出されるという生理学的原理基づいている(文献31、33)。
(補足:であれば、グルコースを飲ませて、わざわざ呼気テストで水素を測定するよりも、レントゲン写真でガスの増加を確かめるべきではないかと、私は考えて、それを実証した。)
これとは対照的に、非吸収性二糖であるラクツロースは、SIBOが存在して、小腸に菌が多く存在する場合は、まず、通常は90分以内に小腸での発酵が起こり、その後、大腸での発酵ピークを生じるため、2つのピークを形成する(文献33)。(以上から、SIBOの診断のための水素呼気テストにはいくつかの制限がある。つまり、小腸か大腸かどちらか区別できない場合は、ガス生産の部位がわからないという問題がある(文献34)。初期のピークは、消化管通過時間が速い人の場合、多くは偽陽性となる。例えば、インドからの研究では、健常者の中央値は口から盲腸までの通過時間は65分(40〜110分)であった(文献35)。また、台湾から別の研究では、口から盲腸までの通過時間は85分だった(文献36)。これについては、最近の西洋の集団においてもLHBTと放射性同位元素を使用した方法で実証されている(文献17、39)。LHBTを使用したSIBOの診断は二重ピーク基準に対しては非常に鈍感である(文献15、33)。空腸吸引液培養をゴールドスタンダードとした場合、GHBTのSIBOに対する感度は44%である(文献15)。また、LHBTの早い段階でのピークをSIBOと診断すれば、IBSの患者だけでなく、コントロールにおいてもSIBOと高い関連性を示すことになる。これとは対照的に、LHBTとGHBTでダブルピークの基準のいずれかを使用した場合、IBSとコントロールの両方でSIBOの関連は低い結果を導く。LHBT(初期のピーク基準)を用いた場合、IBSでのSIBO発生率は34.5~78%、対照患者でのSIBO発症率)は7~40%であるのに対し、GHBTを用いた場合は、それぞれ、8.5~46%、2~18%と著しく低い。(補足:私の実験では、ラクツロースを飲んだ後のガス増加は、腹部レントゲン写真では、4,5時間後からガスが増加してくる。)
人類の15%はメタン生成細菌叢を有している(文献34、40)。Methanobrevibacter
smithiiとMethanobrevibacter stadmanae、また、おそらく大腸菌群の一部はメタンガスを発生する菌である(文献41)。これらの菌では、水素呼気検査ではSIBOを診断できないことがあり、メタンの推定も必要である。コントロールの0~25%、IBS患者の8.5~26%で呼気にメタンガスが排出される。メタンガスをSIBOの症状の原因と推定していない場合は、メタンガスによるSIBOは診断されない。つまり、多くの研究では、メタンガスを考慮していない研究におけるSIBOの頻度の過小評価になる可能性がある。過剰なメタン生産は便秘と関係している(文献42)。そのため、いくつかの市販の水素呼気試験機で検出できない呼気中のメタンガスは、便秘型IBSの患者において特に重要である。
空腸から液を吸引して培養検査を行うのが最も正確にSIBOを診断する方法であるが、これには5時間の検査時間が必要であるため、それを望まない人が多いであろう(文献43、44)。そのため呼気検査を受ける方法を選択するであろうけれど、その短時間の検査はSIBOを正確に診断できず、陰性とされることが少なくない。空腸液の吸引培養方法はSIBOの基本的なゴールドスタンダードとして使用されている(文献15、45)。しかし、この方法の限界は侵襲性あること、また、すべての菌種を試みることによってもたらされる課題を含んでいる(文献46)。すなわち、空気中に存在する酸素に曝露されると嫌気性菌が増殖しないため、内視鏡検査時の空気の使用により偽陰性の結果をもたらし、細菌の大部分は培養されない(文献47.48)。
また、鼻を通して、または内視鏡の生検チャネルを通過したカテーテルによる採取では、口腔咽頭細菌叢による汚染によって偽陽性の結果を与える可能性がある(文献13)。我々はそのようなことを防止するダブルルーメンカテーテルを設計し口腔咽頭の汚染を回避する方法を行っている(文献13)。
Posserudらの研究ではIBSの患者の4%にしかSIBOはなかったとしている(文献12)。しかし、SIBOがゴールドスタンダードとしての空腸の吸引液培養を考慮し診断すると、それらの診断方法の感度は44%と低いものであった(文献15)。GHBTを使用した他の研究の結果を考慮すると、前者の研究では誤った過小評価といえる。13Cと14Cを使用した方法はDキシロースの細胞代謝の原理に基づいている(文献49)。胆汁酸は細菌で影響をうけるため13Cと14CはSIBOの診断に使用されるが、その原理は、SIBOで空腸に細菌がある場合は、胆汁から排泄され14Cグリシンが細菌によって14CO2 に変化することであり、それが血管へ移行し、呼気で検出されるため、14CO2を測定することでSIBOを診断するものである(文献50、51)。
水素呼気テストは、患者に(通常、グルコースおよびラクツロースの形態で)炭水化物の負荷を与え、ある時間にわたって水素濃度を測定するものである。水素呼気試験を用いたSIBOの診断は、SIBOを有する患者において、グルコースと小腸内細菌によって発酵される水素ガスが産生され、その水素ガスが吸収されて、呼気中に吐き出されるという生理学的原理に基いている(文献31、33)。
これとは対照的に、非吸収性二糖であるラクツロースは、SIBOが存在して、小腸に菌が多く存在する場合は、まず、通常は90分以内に小腸での発酵が起こり、その後、大腸での発酵ピークを生じるため、2つのピークを形成する(文献33)。以上から、SIBOの診断のための水素呼気テストにはいくつかの制限がある。つまり、小腸か大腸かどちらか区別できない場合は、ガス生産の部位がわからないという問題がある(文献34)。初期のピークは、消化管通過時間が速い人の場合、多くは偽陽性となる。例えば、インドからの研究では、健常者の中央値は口から盲腸までの通過時間は65分(40〜110分)であった(文献35)。また、台湾から別の研究では、口から盲腸までの通過時間は85分だった(文献36)。これについては、最近の西洋の集団においてもLHBTと放射性同位元素を使用した方法で実証されている(文献17、39)。LHBTを使用したSIBOの診断は二重ピーク基準に対しては非常に鈍感である(文献15、33)。空腸吸引液培養をゴールドスタンダードとした場合、GHBTのSIBOに対する感度は44%である(文献15)。また、LHBTの早い段階でのピークをSIBOと診断すれば、IBSの患者だけでなく、コントロールにおいてもSIBOと高い関連性を示すことになる。これとは対照的に、LHBTとGHBTでダブルピークの基準のいずれかを使用した場合、IBSとコントロールの両方でSIBOの関連は低い結果を導く。LHBT(初期のピーク基準)を用いた場合、IBSでのSIBO発生率は34.5~78%、対照患者でのSIBO発症率)は7~40%であるのに対し、GHBTを用いた場合は、それぞれ、8.5~46%、2~18%と著しく低い。
人類の15%はメタン生成細菌叢を有している(文献34、40)。Methanobrevibacter smithiiとMethanobrevibacter stadmanae、また、おそらく大腸菌群の一部はメタンガスを発生する菌である(文献41)。これらの菌では、水素呼気検査ではSIBOを診断できないことがあり、メタンの推定も必要である。コントロールの0~25%、IBS患者の8.5~26%で呼気にメタンガスが排出される。メタンガスをSIBOの症状の原因と推定していない場合は、メタンガスによるSIBOは診断されない。つまり、多くの研究では、メタンガスを考慮していない研究におけるSIBOの頻度の過小評価になる可能性がある。過剰なメタン生産は便秘と関係している(文献42)。そのため、いくつかの市販の水素呼気試験機で検出できない呼気中のメタンガスは、便秘型IBSの患者において特に重要である。
空腸から液を吸引して培養検査を行うのが最も正確にSIBOを診断する方法であるが、これには5時間の検査時間が必要であるため、それを望まない人が多いであろう(文献43、44)。そのため呼気検査を受ける方法を選択するであろうけれど、その短時間の検査はSIBOを正確に診断できず、陰性とされることが少なくないのである。GHBTを使用した他の研究の結果を考慮すると、前者の研究では誤った過小評価といえる。13Cと14Cを使用した方法はDキシロースの細胞代謝の原理に基づいている(文献49)。胆汁酸は細菌で影響をうけるため13Cと14CはSIBOの診断に使用されるが、その原理は、SIBOで空腸に細菌がある場合は、胆汁から排泄され14Cグリシンが細菌によって14CO2 に変化することであり、それが血管へ移行し、呼気で検出されるため、14CO2を測定することでSIBOを診断するものである(文献50、51)。
SIBO患者におけるIBS症状を生じるメカニズム
腸管内腔の中の細菌は、多数の腸機能の調節において重要な役割を果たす。小腸の内腔側の細菌の量的変化は、消化吸収が中断される。腸内細菌は、免疫活性化のために重要である(文献52)。免疫に関係するサイトカインは腸管内上皮の分泌異常により、侵害受容シグナルと異常な運動性を来す(文献52、53)。同時に、これらの変化は、IBSの症状につながる可能性がある。また、このメカニズムは、例えば、線維筋痛症のようなオーバーラップ症候群を併発する可能性がある(文献54、55)。腸内細菌叢は腸の機能や、さまざまな疾患の病因、プロバイオティクスの潜在的な価値、および治療法として腸内細菌叢を変化させる他の手段との関係についての研究が最近進んでいるように、腸内細菌叢に新たな関心が高まっている。
SIBOを有する患者において、細菌は小腸で炭水化物を大量に発酵させて、大量のガス生産を引き起こす(文献15)。この異常なガスの蓄積は膨満感や鼓腸を来し、過度の管腔膨満によって腹部の痛みや不快感の原因となる(文献56、57)。人口の15%が水素ガスの代わりにメタンガスを生成する(文献13、34)。メタン生成細菌叢の異常増殖によってメタンガスが過剰に生成されると便秘の原因となることが知られている(文献42)。そして、腸内細菌叢の治療によって呼気のメタンガスの減少とともに、便秘症状が改善することが報告されている(文献58)。
腸内細菌は、小腸と大腸の内側の粘膜を損傷する可能性があり、発酵後の副生成物が毒性を生じることもある(文献59)。SIBOを有する患者の小腸生検を行った研究では、粘膜および陰窩が脆弱になり、上皮内リンパ球が増加していた(文献60)。このような腸壁の変化は、腸内で浸透圧負荷により、下痢を起こすであろう。これまでの研究では、下痢型のIBS患者はSIBOを有する頻度が高いことが明らかであった(文献11、12、14、18 、19)。さらに過剰な細菌は腸に存在する胆汁酸塩により、結腸の水分量が増えて下痢の原因となりうる。その後、腸粘膜に毒性である遊離胆汁酸は、粘膜炎症および炎症誘発性サイトカインの放出を引き起こす可能性がある(文献61、62)。実際にSIBOは、IL-8レベル(炎症性サイトカイン)の増加と関連することが知られている(文献63)。
IBSの病態生理は、腸の運動性の変化、内臓過敏症および異常な脳腸の相互作用が含まれている。一方、小腸に増加した細菌は腸の感覚運動機能に影響を与えることが分かっている(文献64)。エンドトキシン(リポ多糖)は、腸の運動性に影響を与える可能性があり、ホルミル-メチオニル-ロイシル-フェニルアラニンなどの細菌走化性ペプチドは腸神経系と求心性神経を刺激する。SIBO患者における小腸細菌は、例えば、ブチレート、アセテート、プロピオネートなどの短鎖脂肪酸(SCFA)を生成する(文献65)。結腸運動はSCFA によって起因する酸性化によって増加する(文献66、67)。対照的に、SCFAは、回腸におけるペプチドYY、ニューロテンシンおよびグルカゴン様ペプチド-1の放出を近位腸の運動性の低下を招く(文献68)。そのため、腸内細菌叢の変化は、腸管運動の変化を来してIBSの素因となることがある。
IBSにおける腸内細菌叢の治療による証拠
IBS患者の腸内細菌叢は、腸内の発酵により多くのガスが生産され、その結果、健常者と異なっている(文献69-71)。抗生物質やプロバイオティクスによる腸内細菌叢の治療的操作でIBS の症状の改善は、その証拠でもある(文献72、73)。また、多変量解析の研究でもIBSの症状のあるSIBOの改善を認めている(文献14、17、74)。最近の研究でも、SIBOの治療によりIBS を症状軽減することが明らかになっている(文献17、75)。ローマⅠ基準でIBSと診断された患者が抗生物質により小腸の細菌を除菌することによって48%で症状が改善した(文献17)。SIBOは、下痢型のIBSでは他のサブタイプよりも関連が強く、SIBOの治療に用いる抗生物質の投与で下痢型IBSの患者の膨満感、腹痛や軟便などの症状を改善する可能性がある(文献17)。リファキシミンや非吸収性広域スペクトル抗生物質は、SIBOの治療のために使用されている(文献76)。便秘のないIBS患者に対する二重盲検、プラセボ対照試験の第3相試験では、リファキシミンを用いた治療は、プラセボと比較して、膨満感、腹痛、緩みや水様便の改善を認めている(文献77)。
メタン生成細菌叢によって生成されたメタンガスは、IBS と関連付けられている遅いトランジット便秘(腸管運動遅延型便秘)を引き起こすことが明らかにされている(文献58)。最近では、リファキシミンがメタンガスを減少させ、腸通過(便通)を改善することが知られている。単剤としてネオマイシンおよびリファキシミンでの治療は、それぞれ33%、28%であるが、リファキシミンおよびネオマイシンの併用療法の成績では87%が有効であるとされる(文献79)。(補足:ネオマイシンは日本で使用されていない。リファキシミンは日本での適応は、肝性脳症のみである。)
プロバイオティクスの研究でもIBSの症状の改善を示すものがある(文献80、81)。これらの研究では、プロバイオティクスを用いた治療は、慢性の下痢を有する患者における腹痛、排便頻度、緊急性及び膨張の症状を低減するのに有効であったとされる(文献82)。乳酸桿菌は、他の細菌よりもガスの生産が低いため、IBSの患者において乳酸菌の投与はガスに関連した症状を軽減する(文献83)。無作為に割り付けた単盲検無作為化対照試験では、IBS患者はラクトバチルス·アシドフィルス、ラクトバチルス·ヘルベチカス、ビフィドバクテリウムは、プラセボを受けた患者と比較して、痛みや膨満感に有意な改善を示した(文献84)。別の研究では枯草菌、およびストレプトコッカス·フェシウムによる下痢またはIBSを有する患者において、プラセボと比較して、腹部の疼痛を軽減するのに有効であることが報告されている(文献85)。しかし、IBSを有する患者の治療のためのプロバイオティクス治療は、今後、それらの用量および持続時間効果のある最も適した株を調べる必要が求められている。(補足:長期経過の研究は存在しない。)
結論
IBSとSIBOとの間には明確な関連性がある。実際に、IBS症状がある場合、さらに検査をしてSIBOとすべきか、IBSとSIBOの症状が類似しているため、IBSではなくSIBOとして診断を進めるべきかが論争になっている。しかし、IBSを規定しているローマ基準の現在の診断アルゴリズムでは、IBSは、単に症状に基づく基準によって診断される。つまり、適切なテストによるSIBOの除外は、(現時点において)IBSを診断する前の必須な項目ではない。そのため、将来的にはローマ基準のIBS診断アルゴリズムに、少なくともSIBOのより高い確率を有する患者に対して、IBSと診断する前にSIBOを除外することが重要である。しかし、既存のデータの検討から明らかなように、我々はいくつかの研究において、SIBOの診断には、過小評価や過大評価があったと結論付けた。LHBTの早期のピークをSIBOの診断基準とした研究では他の方法よりもSIBOをより多く診断した。最近の報告の多くは、LHBTの早期ピーク基準は偽陽性をもたらし、SIBOを不必要に誇大に評価した可能性が高い(文献14、17、86、87)。GHBTはSIBO を診断するには低感度であるため、GHBTに基づく研究はSIBOの関連性を過小評価した可能性がある(文献15)。空腸吸引液培養法はSIBOの診断のためのゴールドスタンダードとみなされているが、これには限界がある。この方法は患者への侵襲性が最大の問題であり、通常に行われる検査としては許容できない。そこで、IBSとされているSIBOを確実に確認するために、SIBOの臨床診断を的確に知る方法が緊急に必要とされている。
文献
1. Ballou SK, Keefer L. Multicultural considerations in the
diagnosis and management of irritable bowel syndrome: a selective summary. Eur
J Gastroenterol Hepatol. 2013;25:1127–1133. [PubMed]
2. Gonzales Gamarra RG, Ruiz Sánchez JG, León Jiménez F, Cubas
Benavides F, Díaz Vélez C. [Prevalence of irritable bowel syndrome in the adult
population of the city of Chiclayo in 2011] Rev Gastroenterol Peru.
2012;32:381–386. [PubMed]
3. Gwee KA, Lu CL, Ghoshal UC. Epidemiology of irritable bowel
syndrome in Asia: something old, something new, something borrowed. J
Gastroenterol Hepatol. 2009;24:1601–1607. [PubMed]
4. Krogsgaard LR, Engsbro AL, Bytzer P. The epidemiology of
irritable bowel syndrome in Denmark. A population-based survey in adults ≤ 50
years of age. Scand J Gastroenterol. 2013;48:523–529. [PubMed]
5. Ibrahim NK, Battarjee WF, Almehmadi SA. Prevalence and
predictors of irritable bowel syndrome among medical students and interns in
King Abdulaziz University, Jeddah. Libyan J Med. 2013;8:21287. [PMC
free article] [PubMed]
6. Lee YY, Waid A, Tan HJ, Chua AS, Whitehead WE. Rome III survey
of irritable bowel syndrome among ethnic Malays. World J Gastroenterol.
2012;18:6475–6480; discussion p. 6479. [PMC free
article] [PubMed]
7. Ghoshal UC, Abraham P, Bhatt C, Choudhuri G, Bhatia SJ, Shenoy
KT, Banka NH, Bose K, Bohidar NP, Chakravartty K, et al. Epidemiological and
clinical profile of irritable bowel syndrome in India: report of the Indian
Society of Gastroenterology Task Force. Indian J Gastroenterol. 2008;27:22–28.
[PubMed]
8. Bures J, Cyrany J, Kohoutova D, Förstl M, Rejchrt S, Kvetina J,
Vorisek V, Kopacova M. Small intestinal bacterial overgrowth syndrome. World J
Gastroenterol. 2010;16:2978–2990. [PMC
free article] [PubMed]
9. Dibaise JK, Young RJ, Vanderhoof JA. Enteric microbial flora,
bacterial overgrowth, and short-bowel syndrome. Clin Gastroenterol Hepatol.
2006;4:11–20. [PubMed]
10. Bouhnik Y, Alain S, Attar A, Flourié B, Raskine L, Sanson-Le
Pors MJ, Rambaud JC. Bacterial populations contaminating the upper gut in
patients with small intestinal bacterial overgrowth syndrome. Am J
Gastroenterol. 1999;94:1327–1331. [PubMed]
11. Dukowicz AC, Lacy BE, Levine GM. Small intestinal bacterial
overgrowth: a comprehensive review. Gastroenterol Hepatol (N Y) 2007;3:112–122.
[PMC
free article] [PubMed]
12. Posserud I, Stotzer PO, Björnsson ES, Abrahamsson H, Simrén M.
Small intestinal bacterial overgrowth in patients with irritable bowel
syndrome. Gut. 2007;56:802–808. [PMC
free article] [PubMed]
13. Ghoshal U, Ghoshal UC, Ranjan P, Naik SR, Ayyagari A. Spectrum
and antibiotic sensitivity of bacteria contaminating the upper gut in patients
with malabsorption syndrome from the tropics. BMC Gastroenterol. 2003;3:9. [PMC
free article] [PubMed]
14. Carrara M, Desideri S, Azzurro M, Bulighin GM, Di Piramo D,
Lomonaco L, Adamo S. Small intestine bacterial overgrowth in patients with
irritable bowel syndrome. Eur Rev Med Pharmacol Sci. 2008;12:197–202. [PubMed]
15. Ghoshal UC, Ghoshal U, Das K, Misra A. Utility of hydrogen
breath tests in diagnosis of small intestinal bacterial overgrowth in
malabsorption syndrome and its relationship with oro-cecal transit time. Indian
J Gastroenterol. 2006;25:6–10. [PubMed]
16. Ghoshal UC, Kumar S, Mehrotra M, Lakshmi C, Misra A. Frequency
of small intestinal bacterial overgrowth in patients with irritable bowel
syndrome and chronic non-specific diarrhea. J Neurogastroenterol Motil.
2010;16:40–46. [PMC
free article] [PubMed]
17. Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal
bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol.
2000;95:3503–3506. [PubMed]
18. Sachdeva S, Rawat AK, Reddy RS, Puri AS. Small intestinal
bacterial overgrowth (SIBO) in irritable bowel syndrome: frequency and predictors.
J Gastroenterol Hepatol. 2011;26 Suppl 3:135–138. [PubMed]
19. Park H. The role of small intestinal bacterial overgrowth in
the pathophysiology of irritable bowel syndrome. J Neurogastroenterol Motil.
2010;16:3–4. [PMC
free article] [PubMed]
20. Ghoshal UC, Shukla R, Ghoshal U, Gwee KA, Ng SC, Quigley EM.
The gut microbiota and irritable bowel syndrome: friend or foe? Int J Inflam.
2012;2012:151085. [PMC
free article] [PubMed]
21. Brown AC. Ulcerative colitis, Crohn’s disease and irritable
bowel syndrome patients need fecal transplant research and treatment. J Crohns
Colitis. 2014;8:179. [PubMed]
22. Sampath K, Levy LC, Gardner TB. Fecal transplantation: beyond
the aesthetic. Gastroenterology. 2013;145:1151–1153. [PubMed]
23. Grace E, Shaw C, Whelan K, Andreyev HJ. Review article: small
intestinal bacterial overgrowth--prevalence, clinical features, current and
developing diagnostic tests, and treatment. Aliment Pharmacol Ther.
2013;38:674–688. [PubMed]
24. Yakoob J, Abbas Z, Khan R, Hamid S, Awan S, Jafri W. Small
intestinal bacterial overgrowth and lactose intolerance contribute to irritable
bowel syndrome symptomatology in Pakistan. Saudi J Gastroenterol.
2011;17:371–375. [PMC
free article] [PubMed]
25. Gwee KA, Bak YT, Ghoshal UC, Gonlachanvit S, Lee OY, Fock KM,
Chua AS, Lu CL, Goh KL, Kositchaiwat C, et al. Asian consensus on irritable
bowel syndrome. J Gastroenterol Hepatol. 2010;25:1189–1205. [PubMed]
26. Lacy BE, Gabbard SL, Crowell MD. Pathophysiology, evaluation,
and treatment of bloating: hope, hype, or hot air? Gastroenterol Hepatol (N Y)
2011;7:729–739. [PMC
free article] [PubMed]
27. Harder H, Serra J, Azpiroz F, Passos MC, Aguadé S, Malagelada
JR. Intestinal gas distribution determines abdominal symptoms. Gut.
2003;52:1708–1713. [PMC
free article] [PubMed]
28. Kumar S, Misra A, Ghoshal UC. Patients with irritable bowel syndrome
exhale more hydrogen than healthy subjects in fasting state. J
Neurogastroenterol Motil. 2010;16:299–305. [PMC
free article] [PubMed]
29. Hungin AP, Mulligan C, Pot B, Whorwell P, Agréus L, Fracasso
P, Lionis C, Mendive J, Philippart de Foy JM, Rubin G, Winchester C, de Wit N.
Systematic review: probiotics in the management of lower gastrointestinal
symptoms in clinical practice -- an evidence-based international guide. Aliment
Pharmacol Ther. 2013;38:864–886. [PMC
free article] [PubMed]
30. Attar A, Flourié B, Rambaud JC, Franchisseur C, Ruszniewski P,
Bouhnik Y. Antibiotic efficacy in small intestinal bacterial overgrowth-related
chronic diarrhea: a crossover, randomized trial. Gastroenterology.
1999;117:794–797. [PubMed]
31. Marcelino RT, Fagundes-Neto U. [Hydrogen test (H2) in the air
expired for the diagnosis of small bowel bacterial overgrowth] Arq
Gastroenterol. 1995;32:191–198. [PubMed]
32. Santavirta J. Lactulose hydrogen and [14C]xylose breath tests
in patients with ileoanal anastomosis. Int J Colorectal Dis. 1991;6:208–211. [PubMed]
33. Ghoshal UC. How to interpret hydrogen breath tests. J
Neurogastroenterol Motil. 2011;17:312–317. [PMC
free article] [PubMed]
34. Yang CY, Chang CS, Chen GH. Small-intestinal bacterial
overgrowth in patients with liver cirrhosis, diagnosed with glucose H2 or CH4
breath tests. Scand J Gastroenterol. 1998;33:867–871. [PubMed]
35. Ghoshal UC, Ghoshal U, Ayyagari A, Ranjan P, Krishnani N,
Misra A, Aggarwal R, Naik S, Naik SR. Tropical sprue is associated with
contamination of small bowel with aerobic bacteria and reversible prolongation
of orocecal transit time. J Gastroenterol Hepatol. 2003;18:540–547. [PubMed]
36. Lu CL, Chen CY, Chang FY, Lee SD. Characteristics of small
bowel motility in patients with irritable bowel syndrome and normal humans: an
Oriental study. Clin Sci (Lond) 1998;95:165–169. [PubMed]
37. Sciarretta G, Furno A, Mazzoni M, Garagnani B, Malaguti P.
Lactulose hydrogen breath test in orocecal transit assessment. Critical
evaluation by means of scintigraphic method. Dig Dis Sci. 1994;39:1505–1510. [PubMed]
38. Rao SS, Camilleri M, Hasler WL, Maurer AH, Parkman HP, Saad R,
Scott MS, Simren M, Soffer E, Szarka L. Evaluation of gastrointestinal transit
in clinical practice: position paper of the American and European
Neurogastroenterology and Motility Societies. Neurogastroenterol Motil.
2011;23:8–23. [PubMed]
39. Yu D, Cheeseman F, Vanner S. Combined oro-caecal scintigraphy
and lactulose hydrogen breath testing demonstrate that breath testing detects
oro-caecal transit, not small intestinal bacterial overgrowth in patients with
IBS. Gut. 2011;60:334–340. [PubMed]
40. Rana SV, Sharma S, Sinha SK, Kaur H, Sikander A, Singh K.
Incidence of predominant methanogenic flora in irritable bowel syndrome
patients and apparently healthy controls from North India. Dig Dis Sci.
2009;54:132–135. [PubMed]
41. Dridi B, Henry M, El Khéchine A, Raoult D, Drancourt M. High
prevalence of Methanobrevibacter smithii and Methanosphaera stadtmanae detected
in the human gut using an improved DNA detection protocol. PLoS One.
2009;4:e7063. [PMC
free article] [PubMed]
42. Chatterjee S, Park S, Low K, Kong Y, Pimentel M. The degree of
breath methane production in IBS correlates with the severity of constipation.
Am J Gastroenterol. 2007;102:837–841. [PubMed]
43. Lunia MK, Sharma BC, Sachdeva S. Small intestinal bacterial
overgrowth and delayed orocecal transit time in patients with cirrhosis and
low-grade hepatic encephalopathy. Hepatol Int. 2013;7:268–273.
44. Resmini E, Parodi A, Savarino V, Greco A, Rebora A, Minuto F,
Ferone D. Evidence of prolonged orocecal transit time and small intestinal
bacterial overgrowth in acromegalic patients. J Clin Endocrinol Metab.
2007;92:2119–2124. [PubMed]
45. Hamilton I, Worsley BW, Cobden I, Cooke EM, Shoesmith JG, Axon
AT. Simultaneous culture of saliva and jejunal aspirate in the investigation of
small bowel bacterial overgrowth. Gut. 1982;23:847–853. [PMC
free article] [PubMed]
46. Corazza GR, Sorge M, Strocchi A, Benati G, Di Sario A,
Treggiari EA, Brusco G, Gasbarrini G. Non-absorbable antibiotics and small
bowel bacterial overgrowth. Ital J Gastroenterol. 1992;24:4–9. [PubMed]
47. Kuwahara T, Ogura Y, Oshima K, Kurokawa K, Ooka T, Hirakawa H,
Itoh T, Nakayama-Imaohji H, Ichimura M, Itoh K, et al. The lifestyle of the
segmented filamentous bacterium: a non-culturable gut-associated
immunostimulating microbe inferred by whole-genome sequencing. DNA Res.
2011;18:291–303. [PMC
free article] [PubMed]
48. Beumer RR, de Vries J, Rombouts FM. Campylobacter jejuni
non-culturable coccoid cells. Int J Food Microbiol. 1992;15:153–163. [PubMed]
49. Fromm H, Sarva RP, Ravitch MM, McJunkin B, Farivar S, Amin P.
Effects of jejunoileal bypass on the enterohepatic circulation of bile acids,
bacterial flora in the upper small intestine, and absorption of vitamin B12.
Metabolism. 1983;32:1133–1141. [PubMed]
50. Yoshida T, McCormick WC, Swell L, Vlahcevic ZR. Bile acid
metabolism in cirrhosis. IV. Characterization of the abnormality in deoxycholic
acid metabolism. Gastroenterology. 1975;68:335–341. [PubMed]
51. Bjørneklett A, Fausa O, Midtvedt T. Bacterial overgrowth in
jejunal and ileal disease. Scand J Gastroenterol. 1983;18:289–298. [PubMed]
52. Vanner S. The small intestinal bacterial overgrowth. Irritable
bowel syndrome hypothesis: implications for treatment. Gut. 2008;57:1315–1321.
[PubMed]
53. Kinross JM, von Roon AC, Holmes E, Darzi A, Nicholson JK. The
human gut microbiome: implications for future health care. Curr Gastroenterol
Rep. 2008;10:396–403. [PubMed]
55. Pimentel M, Wallace D, Hallegua D, Chow E, Kong Y, Park S, Lin
HC. A link between irritable bowel syndrome and fibromyalgia may be related to
findings on lactulose breath testing. Ann Rheum Dis. 2004;63:450–452. [PMC
free article] [PubMed]
56. Simrén M, Stotzer PO. Use and abuse of hydrogen breath tests.
Gut. 2006;55:297–303. [PMC
free article] [PubMed]
57. Gasbarrini A, Lauritano EC, Gabrielli M, Scarpellini E,
Lupascu A, Ojetti V, Gasbarrini G. Small intestinal bacterial overgrowth:
diagnosis and treatment. Dig Dis. 2007;25:237–240. [PubMed]
58. Ghoshal UC, Srivastava D, Verma A, Misra A. Slow transit
constipation associated with excess methane production and its improvement
following rifaximin therapy: a case report. J Neurogastroenterol Motil.
2011;17:185–188. [PMC
free article] [PubMed]
59. Bala L, Ghoshal UC, Ghoshal U, Tripathi P, Misra A, Gowda GA,
Khetrapal CL. Malabsorption syndrome with and without small intestinal
bacterial overgrowth: a study on upper-gut aspirate using 1H NMR spectroscopy.
Magn Reson Med. 2006;56:738–744. [PubMed]
60. Haboubi NY, Lee GS, Montgomery RD. Duodenal mucosal
morphometry of elderly patients with small intestinal bacterial overgrowth:
response to antibiotic treatment. Age Ageing. 1991;20:29–32. [PubMed]
61. Shindo K, Machida M, Koide K, Fukumura M, Yamazaki R.
Deconjugation ability of bacteria isolated from the jejunal fluid of patients
with progressive systemic sclerosis and its gastric pH. Hepatogastroenterology.
1998;45:1643–1650. [PubMed]
62. Wanitschke R, Ammon HV. Effects of dihydroxy bile acids and
hydroxy fatty acids on the absorption of oleic acid in the human jejunum. J
Clin Invest. 1978;61:178–186. [PMC
free article] [PubMed]
63. Shanab AA, Scully P, Crosbie O, Buckley M, O’Mahony L,
Shanahan F, Gazareen S, Murphy E, Quigley EM. Small intestinal bacterial
overgrowth in nonalcoholic steatohepatitis: association with toll-like receptor
4 expression and plasma levels of interleukin 8. Dig Dis Sci.
2011;56:1524–1534. [PubMed]
64. Ghoshal UC, Park H, Gwee KA. Bugs and irritable bowel
syndrome: The good, the bad and the ugly. J Gastroenterol Hepatol.
2010;25:244–251. [PubMed]
65. Barbara G, Stanghellini V, Brandi G, Cremon C, Di Nardo G, De
Giorgio R, Corinaldesi R. Interactions between commensal bacteria and gut
sensorimotor function in health and disease. Am J Gastroenterol.
2005;100:2560–2568. [PubMed]
66. Cherbut C, Aubé AC, Blottière HM, Galmiche JP. Effects of
short-chain fatty acids on gastrointestinal motility. Scand J Gastroenterol
Suppl. 1997;222:58–61. [PubMed]
67. Ramakrishna BS, Roediger WE. Bacterial short chain fatty
acids: their role in gastrointestinal disease. Dig Dis. 1990;8:337–345. [PubMed]
68. Dumoulin V, Moro F, Barcelo A, Dakka T, Cuber JC. Peptide YY,
glucagon-like peptide-1, and neurotensin responses to luminal factors in the
isolated vascularly perfused rat ileum. Endocrinology. 1998;139:3780–3786. [PubMed]
69. Balsari A, Ceccarelli A, Dubini F, Fesce E, Poli G. The fecal
microbial population in the irritable bowel syndrome. Microbiologica.
1982;5:185–194. [PubMed]
70. Nobaek S, Johansson ML, Molin G, Ahrné S, Jeppsson B.
Alteration of intestinal microflora is associated with reduction in abdominal
bloating and pain in patients with irritable bowel syndrome. Am J
Gastroenterol. 2000;95:1231–1238. [PubMed]
71. Cummings JH, Macfarlane GT. The control and consequences of
bacterial fermentation in the human colon. J Appl Bacteriol. 1991;70:443–459. [PubMed]
72. Camilleri M. Probiotics and irritable bowel syndrome:
rationale, mechanisms, and efficacy. J Clin Gastroenterol. 2008;42 Suppl 3 Pt
1:S123–S125. [PubMed]
73. Spiller R. Probiotics: an ideal anti-inflammatory treatment
for IBS? Gastroenterology. 2005;128:783–785. [PubMed]
74. Ford AC, Spiegel BM, Talley NJ, Moayyedi P. Small intestinal
bacterial overgrowth in irritable bowel syndrome: systematic review and
meta-analysis. Clin Gastroenterol Hepatol. 2009;7:1279–1286. [PubMed]
75. Cuoco L, Salvagnini M. Small intestine bacterial overgrowth in
irritable bowel syndrome: a retrospective study with rifaximin. Minerva
Gastroenterol Dietol. 2006;52:89–95. [PubMed]
76. Di Stefano M, Corazza GR. Treatment of small intestine
bacterial overgrowth and related symptoms by rifaximin. Chemotherapy. 2005;51
Suppl 1:103–109. [PubMed]
77. Pimentel M, Lembo A, Chey WD, Zakko S, Ringel Y, Yu J, Mareya
SM, Shaw AL, Bortey E, Forbes WP. Rifaximin therapy for patients with irritable
bowel syndrome without constipation. N Engl J Med. 2011;364:22–32. [PubMed]
78. Hwang L, Low K, Khoshini R, Melmed G, Sahakian A, Makhani M,
Pokkunuri V, Pimentel M. Evaluating breath methane as a diagnostic test for
constipation-predominant IBS. Dig Dis Sci. 2010;55:398–403. [PubMed]
79. Low K, Hwang L, Hua J, Zhu A, Morales W, Pimentel M. A
combination of rifaximin and neomycin is most effective in treating irritable
bowel syndrome patients with methane on lactulose breath test. J Clin
Gastroenterol. 2010;44:547–550. [PubMed]
81. Quigley EM, Quera R. Small intestinal bacterial overgrowth:
roles of antibiotics, prebiotics, and probiotics. Gastroenterology.
2006;130:S78–S90. [PubMed]
82. Xiao SD, Zhang DZ, Lu H, Jiang SH, Liu HY, Wang GS, Xu GM,
Zhang ZB, Lin GJ, Wang GL. Multicenter, randomized, controlled trial of
heat-killed Lactobacillus acidophilus LB in patients with chronic diarrhea. Adv
Ther. 2003;20:253–260. [PubMed]
83. O'Mahony L, McCarthy J, Kelly P, Hurley G, Luo F, Chen K,
O’Sullivan GC, Kiely B, Collins JK, Shanahan F, et al. Lactobacillus and
bifidobacterium in irritable bowel syndrome: symptom responses and relationship
to cytokine profiles. Gastroenterology. 2005;128:541–551. [PubMed]
84. Tsuchiya J, Barreto R, Okura R, Kawakita S, Fesce E, Marotta
F. Single-blind follow-up study on the effectiveness of a symbiotic preparation
in irritable bowel syndrome. Chin J Dig Dis. 2004;5:169–174. [PubMed]
85. Kim YG, Moon JT, Lee KM, Chon NR, Park H. [The effects of
probiotics on symptoms of irritable bowel syndrome] Korean J Gastroenterol.
2006;47:413–419. [PubMed]
86. Park JS, Yu JH, Lim HC, Kim JH, Yoon YH, Park HJ, Lee SI.
[Usefulness of lactulose breath test for the prediction of small intestinal
bacterial overgrowth in irritable bowel syndrome] Korean J Gastroenterol.
2010;56:242–248. [PubMed]
87. Mann NS, Limoges-Gonzales M. The prevalence of small
intestinal bacterial vergrowth in irritable bowel syndrome.
Hepatogastroenterology. 2009;56:718–721. [PubMed]
88. Scarpellini E, Giorgio V, Gabrielli M, Lauritano EC,
Pantanella A, Fundarò C, Gasbarrini A. Prevalence of small intestinal bacterial
overgrowth in children with irritable bowel syndrome: a case-control study. J
Pediatr. 2009;155:416–420. [PubMed]
89. Nucera G, Gabrielli M, Lupascu A, Lauritano EC, Santoliquido
A, Cremonini F, Cammarota G, Tondi P, Pola P, Gasbarrini G, et al. Abnormal
breath tests to lactose, fructose and sorbitol in irritable bowel syndrome may
be explained by small intestinal bacterial overgrowth. Aliment Pharmacol Ther.
2005;21:1391–1395. [PubMed]
90. Reddymasu SC, Sostarich S, McCallum RW. Small intestinal bacterial
overgrowth in irritable bowel syndrome: are there any predictors? BMC
Gastroenterol. 2010;10:23. [PMC
free article] [PubMed]
91. Lombardo L, Foti M, Ruggia O, Chiecchio A. Increased incidence
of small intestinal bacterial overgrowth during proton pump inhibitor therapy.
Clin Gastroenterol Hepatol. 2010;8:504–508. [PubMed]
92. Parodi A, Dulbecco P, Savarino E, Giannini EG, Bodini G, Corbo
M, Isola L, De Conca S, Marabotto E, Savarino V. Positive glucose breath
testing is more prevalent in patients with IBS-like symptoms compared with
controls of similar age and gender distribution. J Clin Gastroenterol.
2009;43:962–966. [PubMed]
93. Rana SV, Sinha SK, Sikander A, Bhasin DK, Singh K. Study of
small intestinal bacterial overgrowth in North Indian patients with irritable
bowel syndrome: a case control study. Trop Gastroenterol. 2008;29:23–25. [PubMed]
94. Majewski M, McCallum RW. Results of small intestinal bacterial
overgrowth testing in irritable bowel syndrome patients: clinical profiles and
effects of antibiotic trial. Adv Med Sci. 2007;52:139–142. [PubMed]
95. Lupascu A, Gabrielli M, Lauritano EC, Scarpellini E,
Santoliquido A, Cammarota G, Flore R, Tondi P, Pola P, Gasbarrini G, et al.
Hydrogen glucose breath test to detect small intestinal bacterial overgrowth: a
prevalence case-control study in irritable bowel syndrome. Aliment Pharmacol
Ther. 2005;22:1157–1160. [PubMed]
コメント
コメントを投稿